Sigma предлагает роторы с фиксированным углом, поворотно-откидные роторы и барабанные роторы для всех центрифуг Sigma. Роторы Sigma изготавливаются с высок...
27.09.2020 / 01:46СТЕНДЫ ДЛЯ ЛЕЙКОФИЛЬТРАЦИИ В СЛУЖБЕ КРОВИ
Почему важно удалить лейкоциты из компонентов крови?
Где нужно проводить лейкофильтрацию?
Как правильно делать лейкофильтрацию?
Как построены стенды для лейкофильтрации?
При разделении цельной крови на компоненты всегда остаются окончательные лейкоциты, согласно современным нормативам, их количество в дозе крови не должно превышать 1х106 единиц. Достичь таких показателей удается только заготавливающие компоненты крови методом афереза: плазмафереза и цитофереза для тромбоцитов и эритроцитов. Но на сегодняшний день преимущественное несколько компонентов крови получается из цельной крови механическим разделением на плазму, эритроциты и тромбоциты.
Почему важно удалить лейкоциты из компонентов крови?
При разделении цельной крови методом центрифугирования большое количество лейкоцитов не только остается в эритроцитах и плазме, но и попадает в них при перемещении контейнеров по помещению и неточному разделению слоев. К сожалению, уберечься от этого невозможно.
Кроме того, несмотря на присутствие антикоагулянтов, уже к третьим суткам хранения в контейнере появляются микросгустки размером до 100 мкм, количество которых возрастает многократно уже после 5-х суток. Фильтрация такой крови у пациента может привести к ушибу лейкофильтра сгустками и требует использования нескольких фильтров, что приводит к лишнему времени и существенному удорожанию процедуры. Это требует выполнения лейкофильтрации в центре крови, сразу после заготовки компонентов. Тогда вторичная фильтрация уже в больнице может быть выполнена встроенным в систему для трансфузии фильтром исключительно от сгустков. Как показывает опыт, использование лейкофильтров почти в 4 раза уменьшает вероятность развития респираторного дистресса синдрома и циркуляторных расстройств. Их причиной как раз и есть микроагрегаты и наличие лейкоцитов. Также уже после первых трансфузий нелейкофильтрованных компонентов крови происходит алоиммунизация реципиента, что приводит при повторных переливаниях компонентов крови к фибрильным (пирогенным) реакциям с возможной гипотензией, мобилизацией нейтрофилов, активацией Т и В лимфоцитов. Этому способствует разрушение перелитых лейкоцитов, выброс из них анафилотоксинов и цитокинов, которые вместе с микроагрегатами вновь способствуют развитию дистресс синдрома.
Трансфузиологам хорошо известен этот эффект, который наряду с возможностью передачи вирусной инфекции через лейкоциты делает должную лейкофильтрацией необходимостью. Известно, что многие вирусы находятся внутри лейкоцитов. Лейкофильтрация значительно снижает риск передачи таких инфекций, как Эпштейн-Барр, парвовирусы и другие, преимущественно находящиеся в середине клетки и также таких как гепатиты В и С, где вирус находится и в плазме, но снижение вирусной нагрузки уменьшает вероятность инфицирования.
Где нужно проводить лейкофильтрацию?
Таким образом, становится понятным, что важно провести лейкофильтрацию скорее после получения компонента крови во избежание «эффекта задержки» когда фильтр забивается микроагрегантами. Кроме того, во время хранения лейкоциты частично разрушаются, и эти обломки, содержащие антигены и генетический материал с потенциальной вирусной опасностью, почти не отфильтровываются.
Также очень важна повторная фильтрация перед переливанием, которая уже направлена на извлечение микросгустков и остаточных лейкоцитов.
Это означает, что стенды для лейкофильтрации должны быть как в центре крови, так и в больницах, где происходят трансфузии.
Как правильно делать лейкофильтрацию?
Современные контейнеры для забора крови могут с завода комплектоваться встроенным лейкофильтром, что позволяет сразу после забора фильтровать. Для подключения лейкофильтров рекомендуют также использовать асептический спаивателям магистралей, что также позволяет сохранить систему физически закрытой. Каждый лейкофильтр требует четко определенного давления жидкости для правильной фильтрации. Для этого исходный контейнер с компонентом крови должен быть на предварительно прописанной в СОП высоте от 120 до 210 мм, что зависит от типа фильтра, типа компонента и прочего. Часто это становится проблемой – когда персонал не может четко зафиксировать мешок разными креплениями. Кустарные крепежи не дают повторяемость и ожидаемость результатов, допускают человеческий фактор, не позволяющий валидировать этот процесс, а соответственно получить продукт по стандарту GMP, чего требует современное законодательство. Стандартизация этой процедуры может быть достигнута только при использовании специальных стендов для лейкофильтрации, обладающих рядом свойств, позволяющих квалифицировать их при валидации процесса производства компонентов крови. Надо добиться четкого понимания врачей центров крови, что остаточные лейкоциты, отфильтрованные ненадлежащим образом несут угрозу. Соответственно компонент, сделанный по стандарту, легче продавать и использовать.

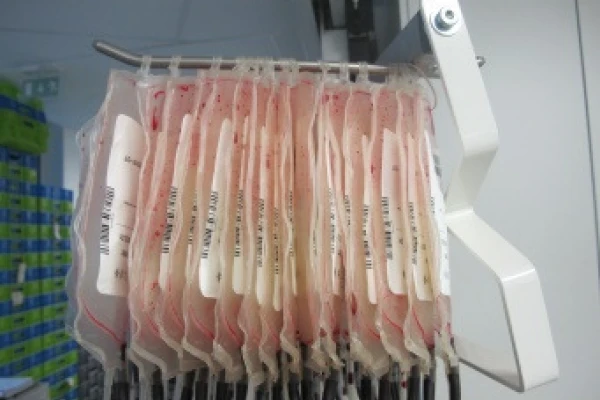
Как построены стенды для лейкофильтрации?
Современные стенды для лейкофильтрации предназначены для получения именно должного, ожидаемого, повторяющегося результата.
Штанга стенда смонтирована на стальной основе. В верхней ее части находится траверса с крючками, на которые цепляются пакеты с компонентами крови, которые нужно фильтровать. От этого контейнера отходит магистраль на которой вмонтирована с завода или с помощью асептического спайщика лейкоцитарный фильтр. После фильтра на конце этой магистрали находится пустой контейнер, который также может быть с завода или подсоединен с пайщиком. Под силой притяжения жидкость из верхнего контейнера перетекает в нижний фильтрующийся в фильтре. Чем выше высота верхнего контейнера, тем больше разность давлений, от чего зависит качество и скорость фильтрации. Оператором устанавливается высота подвеса согласно СОП. После окончания фильтрации нижний контейнер отделяется запаивателем и передается на хранение.
Конструктивно они построены из крепкой устойчивой стали. Позволяют четко регулировать высоту согласно СОП и использовать все виды контейнеров для крови имеющихся в современном центре крови. Количество одновременно обрабатываемых мешков можно регулировать заменяемыми штангами с разным количеством крючков. Лотки, в которых находятся приемные емкости, имеют достаточную площадь и небольшую высоту. Штанга устройства может двигаться, как вручную, так и с электроприводом. Этот существенный момент часто упускают. Но большинство работников в службе крови – это женщины и поднять полностью загруженную штангу на надлежащий уровень бывает почти невозможным. По этой причине пропускная способность стенда снижается, что приводит к дополнительным производственным затратам. То есть часто следует выбирать стенд с электрическийм приводом. Такая система имеет встроенный аккумулятор на 24 V, которого при среднем темпе использования может хватить до 2-х месяцев. Важны эргономические моменты: наличие блокируемых колес, складные лотки, легкость в обработке.
Все это позволяет эффективно получить компонент крови согласно стандартам GMP, что будет безопасно и эффективно.
 Укр
Укр
 Рус
Рус