Наказом Міністерства охорони здоров'я України від 16.09.2011 N 595 прийнято Порядок забезпечення належних умов зберігання, транспортування, прийм...
28.07.2021 / 17:56Системи розділення центрифугованої крові на компоненти
Які бувають компоненти крові? На які шари розділяється кров? Як відокремити кожен отриманий шар в контейнері від іншого? Як працюють ручні плазмоекстрактори? В чому переваги автоматичних плазмоекстракторів?
Міцні зв’язки трансфузіології з імунологією, вірусологією та біотехнологією наприкінці ХІХ століття призвели до появи основного принципу лікування кров’ю – компонентної терапії.
Які бувають компоненти крові?
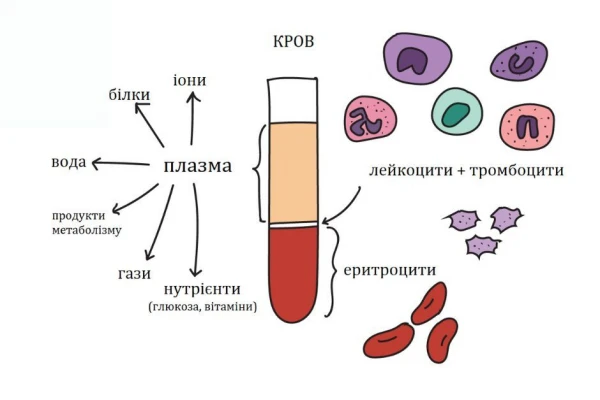
Компонент крові – це її частина, на яку природнім шляхом розподіляється цільна кров при дії на неї центробіжної або гравітаційної сили. Тобто, можна виділити чотири основні компоненти крові: плазма, еритроцити, тромбоцити та лейкоцити. Кожен з них має свою специфічну функцію, індивідуальну і не повторювальну іншими компонентами. На сьогодні відомо близько 50 функцій крові. Серед основних з них плазма відповідає за вміст регуляторних (гормони), живильних (глюкоза, хіломікрони, білки), імунних (IgG, комплемент), осмотичних (мінерали, солі, альбуміни), патологічних (імунні комплекси, метаболіти, яди), згортаючих кров (фібрин, фактори згортання) та багатьох інших речовин, терморегуляцію, водно-сольовий баланс, депо рідини, транспорт, підтримання пружності і об’єму.
Еритроцити відповідають не тільки за транспорт кисню і вуглекислого газу, але й інших речовин. Тромбоцити – за згортання крові. Лейкоцити – за імунну відповідь, а також – за перенесення вірусних інфекцій, оскільки є клітинами з ядрами, на відміну від тромбоцитів і еритроцитів.
Розуміючи навіть ці основні функції стає вочевидь, що треба переливати тільки той компонент, який необхідно для даного пацієнта. А переливання лейкоцитів взагалі треба уникати. Саме це стало основою сучасної компонентної терапії. В розвинених країнах переливання цільної крові заборонено, крім екстремальних умов. Це вимагає її розділення на компоненти, причому якомога швидше після взяття, оскільки якість отриманих компонентів значно знижується з часом.
Для цього використовують центрифугування, що значно прискорює процес у порівнянні з гравітаційними методами.
На які шари розподіляється кров?
В залежності від кількості обертів центрифуги, в контейнерах, що поміщені в неї можна отримати різні шари, на які розподіляється кров. Так, при максимальній швидкості ротора і дуже обережним ставленням з мішками отримують окремо еритроцити, лейкоцити, тромбоцити, збіднену на клітини плазму.
Але найчастіше використовують швидкість при якій отримують три шари: еритроцити, ЛТШ і плазму. ЛТШ – це лейкотромбоцитарний шар, в якому містяться відповідно лейкоцити і тромбоцити. Його дуже добре видно в пакеті, що дозволяє, використовуючи спеціальні системи, відокремити його від плазми і еритроцитів, які використовуються найчастіше. Рідше треба також отримати і тромбоцити. Для цього кількість обертів у хвилину ще знижують і отримують три шари: еритроцити, лейкоцити; плазму з тромбоцитами. Ці клітини найдрібніші і найменші в крові, що при зниженні швидкості ротора дозволяє отримати таке компонування в контейнері. Якщо з пакета видалити плазму і лейкоцити в мішки-сателіти, то це дозволить надалі ще раз відцентрифугувати плазму і отримати дозу плазми та дозу тромбоцитів.



Все це науково красиво, але як відокремити кожен отриманий шар в контейнері від іншого?
На допомогу приходять механічні, напівавтоматичні або автоматичні апарати. Головне в цьому процесі, це максимально обережно віджати вміст основного мішка в мішки-сателіти пошарово. Тобто, в перший контейнерви відіжмете плазму, в другий ЛТШ і в основному залишаться еритроцити. Але це неможливо без спеціальних систем, оскільки навіть незначне перемішування призведе до необхідності повторного центрифугування. Якщо вчасно при віджимі плазми не зупинитись, то в плазму потраплять лейкоцити, що неприпустимо, а якщо зупинитись трохи раніше, то частина плазми залишиться з ЛТШ і утилізується, що зменшить її кількість в кожній донації.
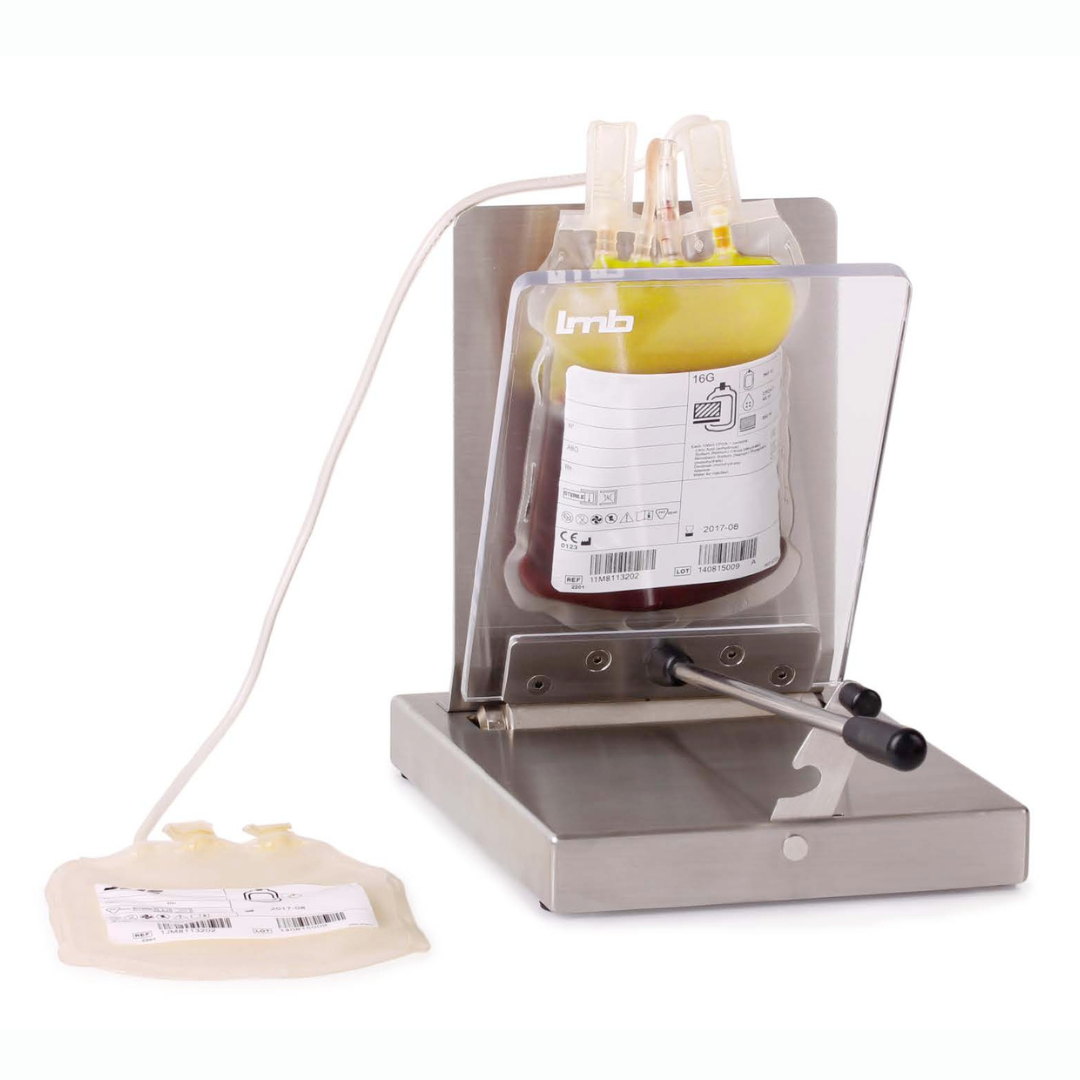
Як працюють ручнівіджимачі?
Для цього було винайдено механічні плазмоекстрактори, де мішок закріплено вертикально, без можливості його зсуву, а збоку відбувається рівномірний, повільний тиск пластиною на всю його поверхню. Таким чином, оператор чітко бачить через прозору пластину, коли рівень плазми доходить до шару ЛТШ і зупиняє віджим, відокремлюючи пакет з плазмою. Так само і з еритроцитами. Це дозволяє отримати компоненти крові. Але постає питання, чи завжди вони будуть якісні? Чи не допустить оператор помилки? Бо незначне потрапляння ЛТШ в плазму буде не помітно, але несе загрозу імунізації, передачі інфекцій, та появи післятрансфузійних реакцій. Сучасні системи якості, які повинні бути в центрах крові згідно з законодавством прямо вимагають виключення людського фактора.
Тільки таким чином можна отримати очікуваний результат, що відповідає стандартам в т.ч. і Plasma Maser File заводу-виробника препаратів крові.
В чому переваги автоматичних віджимачів?
Це вже вимагає автоматизації процесу, тобто поява клітин крові повинна автоматично призводити до перетискання магістралі і зупинки віджиму. Відповідно повинна регулюватися і швидкість віджиму. В ідеалі такі системи мають можливість працювати з декількома мішками-сателітами, заповнюючи їх один за одним шляхом почергового перетискання клапанами магістралей. Це дозволяє отримати очікувану якість продукту. Супутньо використання таких систем значно знижує витрати робочого часу та суттєво підвищує вихід плазми. Так, за попередніми розрахунками, тільки завдяки максимальному виходу плазми такі автомати окупляться вже за один рік після початку їх експлуатації.
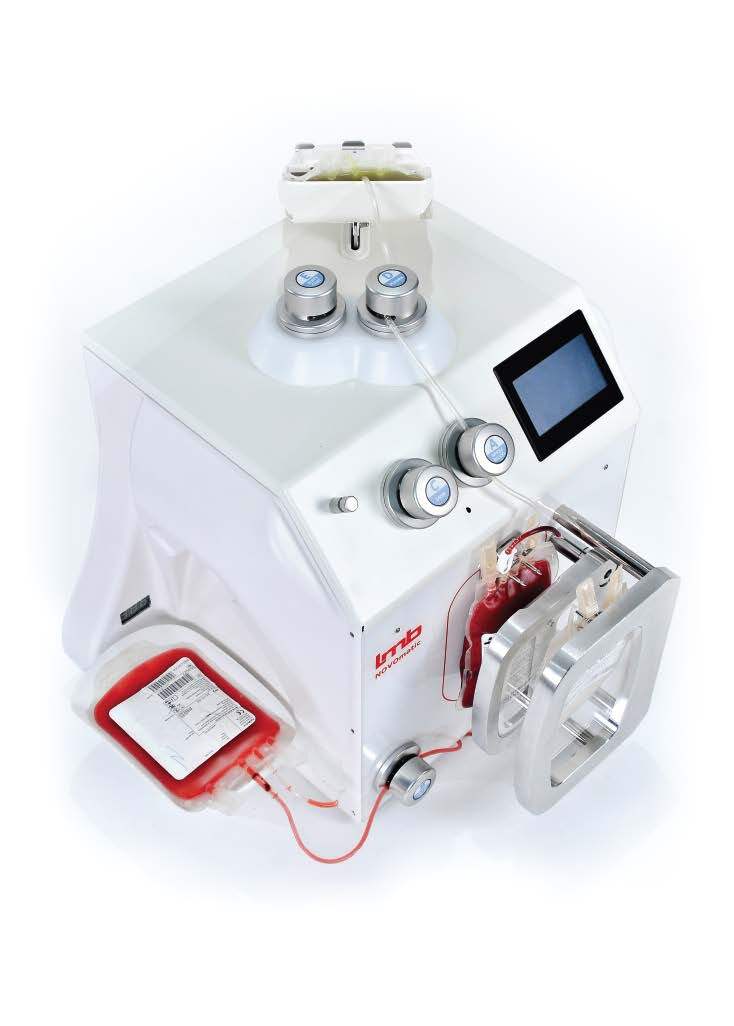
Тільки встановлення таких автоматичних або напівавтоматичних плазмоекстракторів дозволяє валідацію процесу заготівлі цільної крові, оскільки механічний віджимач не може бути кваліфікованим. Належно налаштований автомат дозволяє отримувати плазму, яка майже не вимагає подальшої лейкофільтрації. Цьому сприяє також виконання процедури переносу контейнерів з центрифуги до плазмоекстрактора відповідно навченим персоналом за найменшою відстанню. Так, як навіть незнаний струс мішка призведе до змішування шарів. Ці системи часто мають інформаційний дисплей, де можна обрати програму для конфігурації мішка (кількість сателітів і компонування) та отримати ті чи інші компоненти.
Оптичні сенсори мають чутливість саме на тій довжині хвилі, що активно поглинається еритроцитами, лейкоцитами, і тромбоцитами. Наявність гемолізу теж повинно приводити до зупинки автомата. Деякі системи також слідкують за рівнем еритроцитів у мішку завдяки оптичній лінійці. Ці системи попри серйозну комп’ютеризацію мають простий інтерфейс і зручну ергономіку, щоб мінімізувати підготовку персоналу.
Шляхом оптимізації контролю, використання сенсорів та миттєвого перетискання з’являється можливість значно підвищити швидкість віджиму. Поруч з такими системами часто використовують сканери-штрихкодів, які автоматично пов’язують кожен отриманий компонент з донацією.
Таким чином, використання сучасних систем віджиму відцентрифугованих контейнерів з кров'ю дозволяє отримати більший вихід плазми, і зменшити витрати робочого часу, що знижує собівартість, перешкоджає перемішуванню компонентів, значно підвищує їх якість, дозволяє виключити людський фактор, що сприяє сертифікації за GMP.
Схожі статті
Чи існує такий холодильник, який буде надсилати Вам повідомлення? Так існує. Холодильники ТМ "COOLERMED", виробництва турецької компанії OZTAS, н...
10.04.2021 / 06:26 Укр
Укр
 Рус
Рус