Системы разделения центрифугирования крови на компоненты
Какие компоненты крови бывают? На какие слои разделяется кровь? Как отделить каждый получившийся слой в контейнере от другого? Как работают ручные плазмоэкстракторы? В чем преимущества автоматических плазмоэкстракторов?
Прочные связи трансфузиологии с иммунологией, вирусологией и биотехнологией в конце XIX века привели к появлению основного принципа лечения кровью – компонентной терапии.
Какие компоненты крови бывают?
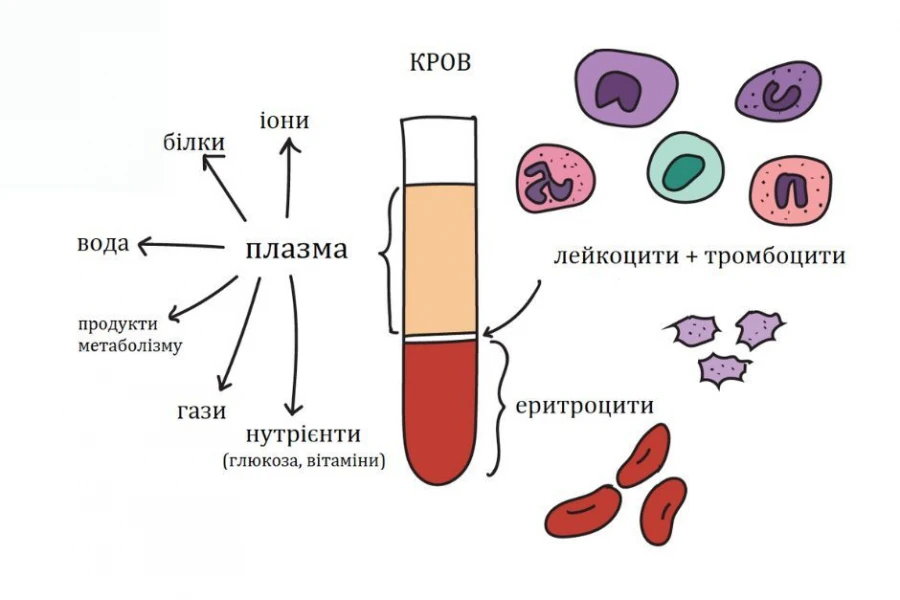
Компонент крови – это ее часть, на которую естественным путем распределяется цельная кровь при воздействии на нее центробежной или гравитационной силы. То есть можно выделить четыре основных компонента крови: плазма, эритроциты, тромбоциты и лейкоциты. Каждый из них имеет свою специфическую функцию, индивидуальную и не повторяющуюся другими компонентами. На сегодняшний день известно около 50 функций крови. Среди основных из них плазма отвечает за содержание регуляторных (гормоны), питательных (глюкоза, хиломикроны, белки), иммунных (IgG, комплемент), осмотических (минералы, соли, альбумины), патологических (иммунные комплексы, метаболиты, яды), свертывающих кровь (фибрин, факторы свертывания) и многих других веществ, терморегуляция, водно-солевой баланс, депо жидкости, транспорт, поддержание упругости и объема.
Эритроциты отвечают не только за транспорт кислорода и углекислого газа, но и за другие вещества. Тромбоциты – при свертывании крови. Лейкоциты – за иммунный ответ, а также – за перенос вирусных инфекций, поскольку являются клетками с ядрами, в отличие от тромбоцитов и эритроцитов.
Понимая даже эти основные функции становится очевидным, что нужно переливать только тот компонент, который необходим для данного пациента. А переливание лейкоцитов вообще следует избегать. Именно это послужило основой современной компонентной терапии. В развитых странах переливание цельной крови запрещено кроме экстремальных условий. Это требует ее разделения на компоненты, причем как можно скорее после взятия, поскольку качество получаемых компонентов значительно снижается со временем.
Для этого используют центрифугирование, что значительно ускоряет процесс по сравнению с гравитационными методами.
На какие слои распределяется кровь?
В зависимости от количества оборотов центрифуги, в помещенных в нее контейнерах можно получить различные слои, на которые распределяется кровь. Так, при максимальной скорости ротора и очень осторожном отношении с мешками получают отдельно эритроциты, лейкоциты, тромбоциты, обедненные клетками плазму.
Но чаще используют скорость при которой получают три слоя: эритроциты, ЛТШ и плазму. ЛТШ – это лейкотромбоцитарный слой, в котором содержатся соответственно лейкоциты и тромбоциты. Его очень хорошо видно в пакете, что позволяет, используя специальные системы, отделить его от наиболее часто используемых плазмы и эритроцитов. Реже нужно также получить и тромбоциты. Для этого количество оборотов в минуту еще снижают и получают три слоя: эритроциты, лейкоциты; плазму с тромбоцитами. Эти клетки самые мелкие и самые маленькие в крови, что при снижении скорости ротора позволяет получить такую компоновку в контейнере. Если из пакета удалить плазму и лейкоциты в мешки-сателлиты, то это позволит в дальнейшем еще раз концентрировать плазму и получить дозу плазмы и дозу тромбоцитов.
Всё это научно красиво, но как отделить каждый полученный слой в контейнере от другого?
В помощь приходят механические, полуавтоматические или автоматические аппараты. Главное в этом процессе, это максимально осторожно отжать содержимое основного мешка в мешки-сателлиты послойно. То есть, в первый контейнер вы отожмете плазму, во второй ЛТШ и в основном останутся эритроциты. Но это невозможно без специальных систем, поскольку даже незначительное перемешивание приведет к необходимости повторного центрифугирования. Если при отжиме плазмы не остановиться, то в плазму попадут лейкоциты, что недопустимо, а если остановиться немного раньше, то часть плазмы останется с ЛТШ и утилизируется, что уменьшит ее количество в каждой донации.
Как работают ручные отжиматели?
Для этого были изобретены механические плазмоэкстракторы, где мешок закреплен вертикально, без возможности его смещения, а сбоку происходит равномерное, медленное давление пластиной на всю его поверхность. Таким образом, оператор ясно видит через прозрачную пластину, когда уровень плазмы доходит до слоя ЛТШ и останавливает отжим, отделяя пакет с плазмой. Так же и с эритроцитами. Это позволяет получить компоненты крови. Но возникает вопрос, всегда ли они будут качествены? Не допустит ли оператор ошибки? Ибо незначительное попадание ЛТШ в плазму будет не заметно, но несет угрозу иммунизации, передачи инфекций и появления послетрансфузионных реакций. Современные системы качества, которые должны быть в центрах крови согласно законодательству, прямо требуют исключения человеческого фактора.
Только таким образом можно получить ожидаемый результат, соответствующий стандартам в т.ч. и Plasma Maser File завода-производителя препаратов крови.
В чем преимущества автоматических отжимателей?
Это уже требует автоматизации процесса, то есть появление клеток крови должно автоматически приводить к пережатию магистрали и остановке отжима. Соответственно должна регулироваться и скорость отжима. В идеале такие системы могут работать с несколькими мешками-сателлитами, заполняя их один за другим путем поочередного пережатия клапанами магистралей. Это позволяет получить ожидаемое качество продукта. Сопутствующее использование таких систем значительно снижает затраты рабочего времени и существенно повышает выход плазмы. Так, по предварительным расчетам, только благодаря максимальному выходу плазмы такие автоматы окупятся уже через один год после начала их эксплуатации.
Только установка таких автоматических или полуавтоматических плазмоэкстракторов позволяет валидировать процесс заготовки цельной крови, поскольку механический отжиматель не может быть квалифицированным. Должно настроенный автомат позволяет получать плазму, которая почти не требует дальнейшей лейкофильтрации. Этому способствует также выполнение процедуры переноса контейнеров из центрифуги в плазмоэкстрактор соответственно обученным персоналом по наименьшему расстоянию. Так, как даже неведомое сотрясение мешка приведет к смешиванию слоев. Эти системы часто имеют информационный дисплей, где можно выбрать программу конфигурации мешка (количество сателлитов и компоновки) и получить те или иные компоненты.
Оптические сенсоры обладают чувствительностью именно на той длине волны, которая активно поглощается эритроцитами, лейкоцитами и тромбоцитами. Наличие гемолиза тоже должно приводить к остановке автомата. Некоторые системы также следят за уровнем эритроцитов в мешке благодаря оптической линейке. Эти системы, несмотря на серьезную компьютеризацию, имеют простой интерфейс и удобную эргономику, чтобы минимизировать подготовку персонала.
Путем оптимизации контроля, использования сенсоров и мгновенного пережатия появляется возможность значительно повысить скорость отжима. Наряду с такими системами часто используют сканеры-штрихкоды, которые автоматически связывают каждый полученный компонент с донацией.
Таким образом, использование современных систем отжима отцентрифугированных контейнеров с кровью позволяет получить больший выход плазмы и уменьшить затраты рабочего времени, что снижает себестоимость, препятствует перемешиванию компонентов, значительно повышает их качество, позволяет исключить человеческий фактор, способствующий сертификации по GMP.
 Укр
Укр
 Рус
Рус