У ранній історії медицини різні лікарі намагалися змішувати або переливати кров різних людей або тварин з різним ступенем успіху. Близько 25 років тому ...
04.07.2020 / 00:50СТЕНДИ ДЛЯ ЛЕЙКОФІЛЬТРАЦІЇ В СЛУЖБІ КРОВІ
Чому важливо видалити лейкоцити з компонентів крові?
Де потрібно проводити лейкофільтрацію?
Як правильно робити лейкофільтрацію?
Як побудовані стенди для лейкофільтрації?
При розділенні цільної крові на компоненти завжди залишаються остаточні лейкоцити, згідно з сучасними нормативами їх кількість в дозі крові не повинна перевищувати 1х106 одиниць. Досягти таких показників вдається тільки заготовлюючи компоненти крові методом аферезу: плазмаферезу та цитоферезу для тромбоцитів і еритроцитів. Але на сьогодні переважна кілька компонентів крові отримується з цільної крові механічним розділенням на плазму, еритроцити та тромбоцити.
Чому важливо видалити лейкоцити з компонентів крові?
При розділенні цільної крові методом центрифугування велика кількість лейкоцитів не тільки залишається в еритроцитах і в плазмі, а й потрапляє в них при переміщенні контейнерів по приміщенню і неточному розділенні шарів. На жаль, убезпечитися від цього неможливо.
Крім того, незважаючи на присутність антикоагулянтів, вже до третьої доби зберігання в контейнері з’являються мікрозгустки розміром до 100 мкм, кількість яких зростає багаторазово вже після 5-ї доби. Фільтрування такої крові біля пацієнта може призвести до забиття лейкофільтру згустками і вимагає використовувати декілька фільтрів, наслідком чого є зайвий час та суттєве здорожчання процедури. Це вимагає виконання лейкофільтрації в центрі крові, відразу після заготівлі компонентів. Тоді вторинна фільтрація, вже в лікарні, може бути виконана вбудованим в систему для трансфузії фільтром виключно від згустків. Як показує досвід, використання лейкофільтрів майже у 4 рази зменшує вірогідність розвитку респіраторного дистрес синдрому та циркуляторних розладів. Їх причиною як раз і є мікроагрегати та наявність лейкоцитів. Також вже після перших трансфузій нелейкофільтрованих компонентів крові відбувається алоімунізація реципієнта, що призводить при повторних переливаннях компонентів крові до фібрильних (пірогенних) реакцій з можливою гіпотензією, мобілізацією нейтрофілів, активацією Т та В лімфоцитів. Цьому сприяє руйнування перелитих лейкоцитів, викид з них анафілотоксинів і цитокінів, які разом з мікроагрегатами знову також сприяють розвитку дистрес синдрому.
Трансфузіологам добре відомий цей ефект, який поруч з можливістю передачі вірусної інфекції через лейкоцити робить належну лейкофільтрацією необхідністю. Відомо, що багато вірусів знаходиться всередині лейкоцитів. Лейкофільтрація значно знижує ризик передачі таких інфекцій, як Епштейн-Барр, парвовіруси та інші, що переважно знаходяться в середині клітини та також таких як гепатити В і С де вірус знаходиться і в плазмі, але зниження вірусного навантаження зменшує вірогідність інфікування.
Де потрібно проводити лейкофільтрацію?
Таким чином, стає зрозумілим, що важливо провести лейкофільтрацію найскоріше після отримання компонента крові, щоб уникнути «ефекта затримки» коли фільтр забивається мікроагрегантами. Крім того, лейкоцити під час зберігання частково руйнуються, і ці уламки, що містять антигени та генетичний матеріал з потенційною вірусною небезпекою майже не відфільтровуються.
Також дуже важливе повторне фільтрування перед переливанням, що вже спрямоване на вилучення мікрозгустків і залишкових лейкоцитів.
Це означає, що стенди для лейкофільтрації повинні бути як в центрі крові, так і в лікарнях де відбуваються трансфузії.
Як правильно робити лейкофільтрацію?
Сучасні контейнери для забору крові можуть із заводу комплектуватися вбудованим лейкофільтром, що дозволяє відразу після забору здійснювати фільтрацію. Для під’єднання лейкофільтрів рекомендують також використовувати асептичний зпаювач магістралей, що також дозволяє зберегти систему фізично закритою. Кожен лейкофільтр вимагає чітко визначеного тиску рідини для належної фільтрації. Для цього вихідний контейнер з компонентом крові повинен бути на попередньо прописаній в СОП висоті від 120 до 210 мм, що залежить від типу фільтра, типу компонента та іншого. Часто це стає проблемою – коли персонал не може чітко зафіксувати мішок різними кріпленнями. Кустарні кріплення не дають повторюваність та очікуваність результатів, допускають людський фактор, що не дозволяє валідувати цей процес, а відповідно отримати продукт за стандартом GMP, чого вимагає сучасне законодавство. Стандартизація цієї процедури може бути досягнена тільки при використанні спеціальних стендів для лейкофільтрації, які мають низку властивостей, що дозволяють кваліфікувати їх при валідації процесу виробництва компонентів крові. Треба добитися чіткого розуміння лікарів центрів крові, що залишкові лейкоцити, які відфільтровані неналежним чином несуть загрозу. Відповідно, компонент, зроблений за стандартом, легше продавати і використовувати.

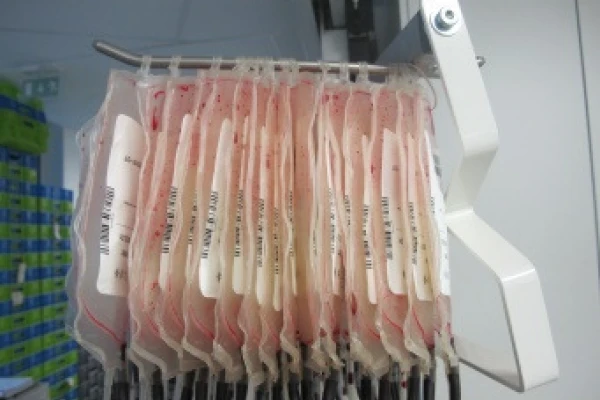
Як побудовані стенди для лейкофільтрації?
Сучасні стенди для лейкофільтрації призначені для отримання саме належного, очікуваного, повторювального результату.
Штанга стенда змонтована на сталевій основі. У верхній її частині знаходиться траверса з гачками на які чіпляються пакети з компонентами крові, що треба фільтрувати. Від цього контейнера відходить магістраль на якій вмонтовано з заводу, або за допомогою асептичного зпаювача, лейкоцитарний фільтр. Після фільтру на кінці цієї магістралі знаходиться пустий контейнер, який також може бути з заводу, або приєднаний зпаювачем. Під силою тяжіння рідина із верхнього контейнера перетікає в нижній фільтруючись у фільтрі. Чим вище висота верхнього контейнера, тим більше різниця тисків, від чого залежить якість і швидкість фільтрації. Оператором встановлюється висота підвісу згідно СОП. Після закінчення фільтрації нижній контейнер відокремлюється запаювачем і передається на зберігання.
Конструктивно вони побудовані з міцної стійкої сталі. Дозволяють чітко регулювати висоту згідно СОП і використовувати всі види контейнерів для крові, які є в сучасному центрі крові. Кількість контейнерів, що одночасно обробляються можна регулювати замінними штангами з різною кількістю гачків. Лотки, в яких знаходяться приймальні ємності, мають достатню площу і невелику висоту. Штанга пристрою може рухатися, як і вручну, так і з електроприводом. Цей суттєвий момент часто упускають. Але більшість працівників у службі крові це жінки і підняти повністю завантажену штангу на належний рівень буває майже не можливим. З цієї причини пропускна спроможність стенда знижується, що веде до додаткових виробничих витрат. Тобто часто варто обирати стенд з електричним приводом. Така система має вбудований акумулятор на 24 V, якого при середньому темпі використанні може вистачити до 2-х місяців. Важливими є ергономічні моменти: наявність колес, що блокуються, складні лотки, легкість в обробці.
Все це дозволяє ефективно отримати компонент крові згідно з стандартами GMP, що буде безпечним та ефективним.
 Укр
Укр
 Рус
Рус